ความแตกต่างระหว่าง Alkalinity และ Basicity | Alkalinity vs Basicity
- ความเป็นด่าง (Alkalinity vs. Basicity)
ทั้งสองคำ "ความเป็นด่าง" และ "พื้นฐาน" ค่อนข้างสับสน คนส่วนใหญ่รู้ว่ามีความแตกต่างระหว่างสองพารามิเตอร์นี้ แต่มีเพียงไม่กี่คนเท่านั้นที่สามารถกำหนดได้อย่างถูกต้อง ข้อแตกต่างที่สำคัญ ระหว่างสองคำนี้จะอธิบายได้ดีที่สุดในคำนิยาม ความเป็นพื้นฐานคือการวัดที่ขึ้นอยู่กับระดับความเป็นกรด - ด่าง และ ความเป็นด่างคือปริมาณกรดที่จำเป็นในการลด pH ลงเป็นค่ากรดที่สำคัญ เป็นที่รู้จักกันในชื่อ ความสามารถในการเก็บบัฟเฟอร์ของตัวถังน้ำ กล่าวอีกนัยหนึ่งค่าความเป็นกรด - ด่างของสารละลายพื้นฐานแตกต่างกันไปในแต่ละช่วงตั้งแต่ 7-14; ซึ่งสารละลายที่มีค่า pH สูงมีความเป็นพื้นฐานมากขึ้น ทั้งสองมีความหมายหลายประการ แต่แนวคิดทั่วไปคล้ายกัน
อัลคาไลนิตี้คืออะไร?
ความเป็นด่างเป็น พารามิเตอร์ที่สำคัญที่สุดในร่างกายของสัตว์น้ำและเป็นสิ่งจำเป็นสำหรับสิ่งมีชีวิตในน้ำ ความเป็นด่างช่วยวัดความสามารถของน้ำเพื่อต่อต้านกรดและเบส กล่าวอีกนัยหนึ่งความจุบัฟเฟอร์ของตัวถังน้ำเพื่อรักษาค่า pH ให้อยู่ในระดับที่มั่นคงพอสมควร คาร์บอเนต (CO 3 2- ) และไฮดรอกไซด์ (OH - ) เป็นสารบัฟเฟอร์ที่ดี; พวกเขาสามารถรวมกับ H + ไอออนในน้ำเพื่อเพิ่ม pH (กลายเป็นพื้นฐาน) ของน้ำ เมื่อความเป็นด่างต่ำเกินไป (ความสามารถในการเก็บบัฟเฟอร์ต่ำ) กรดใด ๆ ที่เพิ่มเข้าไปในตัวน้ำจะลดค่า pH ให้มีค่าเป็นกรดสูงขึ้น
- ในทฤษฎี Bronsted-Lowry ตัวรับโปรตอนจะเรียกว่า base ตามทฤษฎีลูอิสผู้บริจาคอิเล็กตรอนคู่เรียกว่าฐาน Basicity คือไอออนไนซ์ความแรงในการผลิตไอออนของโอโซน - ความสามารถในการรับโปรตอนหรือความสามารถในการบริจาคอิเล็กตรอน โทมัสมาร์ตินโลว์รีย์ - Bronsted-Lowry Theory อะไรคือความแตกต่างระหว่าง Alkalinity และ Basicity? ความหมายของความเป็นด่างและพื้นฐาน:
ความเป็นด่าง:
มีคำจำกัดความหลายข้อ
ความเป็นด่างเป็นความสามารถในการทำให้เป็นกลางของสารละลายในตัวอย่างน้ำที่วัดได้ในมิลลิกรัมต่อลิตร
ผลรวมของสารเคมีที่เป็นคาร์บอเนตและ noncarbonate ในตัวอย่างน้ำที่กรอง
ความสามารถของน้ำเพื่อแก้ปัญหากรด ความสามารถในการเก็บบัฟเฟอร์ของน้ำเพื่อรักษาความเป็นกรดคงที่อย่างเป็นธรรมโดยไม่ต้องเปลี่ยนค่า pH เมื่อเติมกรด
พื้นฐาน:
ใช้ทฤษฎีสามข้อเพื่อกำหนดความเป็นกรดและพื้นฐาน
Arrenhius:
ฐานเป็นสายพันธุ์ที่ทำให้เกิดไอออนในการผลิตน้ำโอโซน
- ในน้ำ การเพิ่มขึ้นของ Basicity เมื่ออิออไนซ์เพิ่มขึ้นทำให้ OH
- ในน้ำ Bronsted-Lowry: ตัวรับโปรตอน (H + ) เรียกว่าฐาน
Lewis: ผู้บริจาคอิเล็กตรอนคู่เรียกว่า base ปัจจัยที่มีผลต่อความเป็นด่างและความเป็นกรด: ความเป็นด่าง:
ความเป็นด่างไม่ขึ้นกับค่าความเป็นกรด - ด่าง เนื้อน้ำสามารถมีค่า pH ต่ำ (มีความเป็นกรด) หรือสูงกว่า (พื้นฐาน) ที่มีค่าความเป็นด่างมากขึ้น ความเป็นด่างจะพิจารณาจากปัจจัยหลายอย่างเช่นหินหินดินเกลือและกิจกรรมทางอุตสาหกรรมบางประเภท <น้ำ (น้ำเสียที่มีสบู่และผงซักฟอกเป็นด่าง) โดยมนุษย์ ตัวอย่างเช่นบริเวณที่มีหินปูน (CaCO 3
) มีอยู่อย่างมากสามารถมีน้ำอัลคาไลน์ได้
ความเป็นปึกแผ่น: ปัจจัยที่มีผลต่อความเป็นพื้นฐานของสารประกอบแตกต่างกันขึ้นอยู่กับความหมายของพื้นฐาน ตัวอย่างเช่นความพร้อมของคู่อิเล็กตรอนของฐานขึ้นอยู่กับปัจจัยสามประการ ความอิ่มตัวของอิเล็กตรอน : CH3-> NH2-> HO-> F- เมื่อพิจารณาอะตอมในแถวเดียวกันในตารางธาตุอะตอมของอิเล็กตรอนที่มีพลังงานมากที่สุดมีความเป็นเบสที่สูงกว่า ขนาด
: F-> Cl-> Br-> I- เมื่อพิจารณาแถวของตารางธาตุอะตอมที่มีขนาดใหญ่จะมีความหนาแน่นของอิเล็กตรอนน้อยกว่าและน้อยกว่าขั้นพื้นฐาน
เรโซแนนซ : RO-> RCO
2-
โมเลกุลที่มีโครงสรางกําลังมากกวานั้นมีพื้นฐานไมนอยกวา รูปภาพมารยphép:
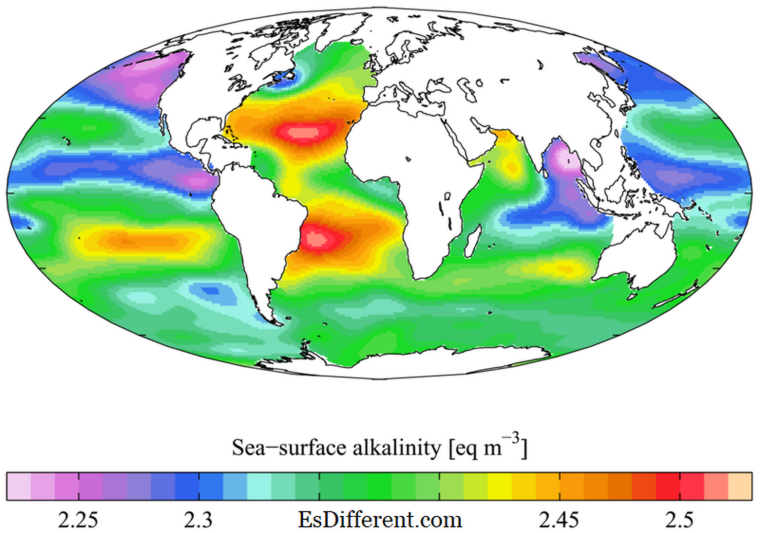
1. "WOA05 GLODAP pd ALK AYool" ของ Plumbago - งานของตัวเอง [CC BY-SA 3. 0] ผ่านทาง Commons
2. "โทมัสมาร์ติน Lowry2" โดยไม่ประสงค์ออกนาม - ข่าวมรณกรรมโดย Faraday Soc (1936) [Public Domain] ผ่านทาง Commons


