ความแตกต่างระหว่างสารประกอบไอออนิกกับโควาเลนต์ Ionic vs Covalent Compounds
ความแตกต่างสำคัญ - ไอออนิกและสารประกอบโควาเลนต์
มีความแตกต่างกันมากระหว่างสารประกอบไอออนิกและโควาเลนต์ น้ำ, การนำไฟฟ้า, จุดหลอมเหลวและจุดเดือด เหตุผลหลักสำหรับความแตกต่างเหล่านี้คือความแตกต่างในรูปแบบพันธะของพวกเขา ดังนั้นรูปแบบพันธะ จึงถือได้ว่าเป็น ความแตกต่างที่สำคัญระหว่าง สารประกอบไอออนิกและโควาเลนต์ (ความแตกต่างระหว่างพันธะไอโอนิกและพันธะโคเวเลนท์) เมื่อมีการสร้างพันธะไอออนิกอิเล็กตรอนถูกบริจาคโดยโลหะและอิเล็กตรอนที่ได้รับบริจาคจะได้รับการยอมรับโดยอโลหะ พวกเขาสร้างพันธบัตรที่แข็งแกร่งเนื่องจากสถานที่น่าสนใจไฟฟ้าสถิต พันธบัตรโควาเลนต์เกิดขึ้นระหว่างโลหะที่ไม่ใช่สองชนิด ในพันธะโควาเลนต์อะตอมสองตัวจะใช้อิเล็กตรอนร่วมกันเพื่อให้เป็นไปตามกฎของ octet โดยทั่วไปพันธบัตรไอออนิกจะมีพลังมากกว่าโควาเลนต์ นี้นำไปสู่ความแตกต่างในคุณสมบัติทางกายภาพของพวกเขา
สารประกอบไอออนคืออะไร?
พันธะไอออนิกจะเกิดขึ้นเมื่ออะตอมสองอะตอมมีค่าอิเล็กโตรจีเนทที่แตกต่างกันมาก ในกระบวนการของการสร้างพันธะอะตอมสูญเสียอิเล็กตรอนสูญเสียอิเล็กตรอน (s) และอิเล็กตรอนอิเล็กตรอนมากขึ้นจะได้รับอิเล็กตรอนเหล่านั้น (s) ดังนั้นชนิดที่เกิดเป็นไอออนที่มีประจุตรงข้ามและพวกเขาสร้างความผูกพันเนื่องจากแรงดึงดูดที่แข็งแกร่งไฟฟ้าสถิต
พันธะไอออนจะเกิดขึ้นระหว่างโลหะและอโลหะ โดยทั่วไปโลหะไม่มีอิเล็กตรอนความจุมากในเปลือกนอกสุด อย่างไรก็ตามโลหะที่ไม่ใช่มีอยู่ใกล้กับอิเล็กตรอนแปดตัวในเปลือกความมันวาว ดังนั้นโลหะที่ไม่ใช่โลหะมีแนวโน้มที่จะรับอิเล็กตรอนเพื่อให้เป็นไปตามกฎของ octet
ตัวอย่างของสารประกอบไอออนิก เป็น Na + + Cl - NaCl
โซเดียม (โลหะ) มีอิเล็กตรอนความจุเดียวและคลอรีน (ไม่ใช่โลหะ) เจ็ดอิเล็กตรอนความจุ

สารประกอบโควาเลนต์คืออะไร?
สารประกอบโควาเลนท์เกิดขึ้นจากการแบ่งอิเล็กตรอนระหว่างสองอะตอมหรือมากกว่าเพื่อให้เป็นไปตาม "กฎ octet" ชนิดพันธะนี้มักพบในสารประกอบที่ไม่มีโลหะอะตอมของสารประกอบเดียวกันหรือองค์ประกอบใกล้เคียงในตารางธาตุ อะตอมสองอันมีค่าอิเลคโทนต่ำเกือบเท่ากันไม่ได้แลกเปลี่ยนอิเล็กตรอน (รับ / รับ) จากเปลือกความจุของพวกเขา แต่จะแบ่งปันอิเล็กตรอนเพื่อให้ได้ค่าที่ตั้งไว้ของ octet
ตัวอย่างของสารประกอบโควาเลนต์ คือมีเทน (CH 4 ), คาร์บอนมอนอกไซด์ (CO) ไอโอดีน monobromide (IBr)
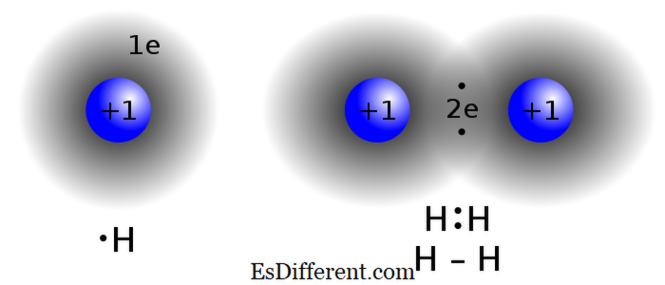
พันธะโควาเลน
อะไรคือความแตกต่างระหว่างไอโอนิกกับโคเวเลนท์ สารประกอบ?
นิยามของสารประกอบไอออนิกและสารประกอบโควาเลนต์
สารประกอบไอโอนิก: สารประกอบไอโอนิกเป็นสารประกอบทางเคมีของไอออนบวกและแอนไอออนที่ยึดกันโดยพันธะไอออนิกในโครงสร้างตาข่าย
สารประกอบโคเวเลนต์: สารประกอบโควาเลนท์เป็นพันธะเคมีที่เกิดจากการแบ่งอิเล็กตรอนอย่างน้อยหนึ่งตัวโดยเฉพาะคู่อิเล็กตรอนระหว่างอะตอม
สมบัติทางฟิสิกส์
สารประกอบไอออนิก:
สารประกอบไอออนิกทั้งหมดมีอยู่ในของแข็งในอุณหภูมิห้อง
สมบัติของสารประกอบไอออนิกและโควาเลนต์
สารประกอบไอออนิกมีโครงสร้างคริสตัลที่มั่นคง ดังนั้นพวกเขาจึงมีจุดหลอมเหลวสูงและจุดเดือด แรงดึงดูดระหว่างไอออนบวกและลบมีความแข็งแรงมาก| - ความแตกต่างของบทความก่อนกลางตาราง -> | สารประกอบไอออนิก | ลักษณะ |
| จุดหลอมเหลว | NaCl - โซเดียมคลอไรด์ | ผลึกสีขาวแข็ง |
| 801 ° C | KCl - โพแทสเซียมคลอไรด์ | แก้วคริสตัลสีขาวหรือสีไม่มีสี |
| 770 ° C MgCl 2 - แมกนีเซียมคลอไรด์ | ของแข็งที่เป็นผลึกขาวหรือไม่มีสี | 1412 ° C |
สารประกอบโควาเลนต์: สารประกอบโคเวเลนต์มีอยู่ในทั้งสามรูปแบบ เป็นของแข็งของเหลวและก๊าซที่อุณหภูมิห้อง
จุดหลอมเหลวและจุดเดือดของพวกเขาค่อนข้างต่ำเมื่อเทียบกับสารประกอบไอออนิก
Compound Covalent
| ลักษณะที่ปรากฏ | จุดหลอมเหลว | ไฮโดรเจนคลอไรด์ |
| ก๊าซที่ไม่มีสี | -114 2 ° C | CH |
| 4 -Methane ก๊าซไม่มีสี | -182 ° C | CCl |
| 4 - คาร์บอนเตตระคลอไรด์ -23 ° C | การนำไฟฟ้า | สารประกอบไอออนิก: |
สารประกอบไอออนิกแข็งไม่มีอิเล็กตรอนอิสระ ดังนั้นพวกเขาจึงไม่ทำไฟฟ้าในรูปของแข็ง แต่เมื่อสารประกอบไอออนิกถูกละลายในน้ำทำให้สารละลายนำไฟฟ้า กล่าวอีกนัยหนึ่งสารประกอบไอออนิกของน้ำเป็นตัวนำไฟฟ้าที่ดี
สารประกอบโควาเลนต์: สารประกอบโควาเลนต์บริสุทธิ์หรือรูปแบบที่ละลายในน้ำไม่ได้เป็นตัวนำกระแสไฟฟ้า ดังนั้นสารประกอบโควาเลนต์เป็นตัวนำไฟฟ้าที่ไม่ดีในทุกขั้นตอน
ความสามารถในการละลาย สารประกอบไอออนิก:
สารประกอบไอออนิกส่วนใหญ่สามารถละลายได้ในน้ำ แต่ไม่ละลายในตัวทำละลายที่ไม่ใช่ขั้ว
สารประกอบโควาเลนต์: สารประกอบโควาเลนเต้ส่วนใหญ่สามารถละลายได้ในตัวทำละลายที่ไม่ใช่ขั้วโลก แต่ไม่อยู่ในน้ำ
ความแข็ง สารประกอบไอออนิก:
ไอออนิกแข็งเป็นสารประกอบแข็งและเปราะ
สารประกอบโควาเลนต์: โดยทั่วไปสารประกอบโควาเลนต์จะนุ่มกว่าของแข็งไอออนิก
รูปภาพมารยาท: "ไฮโดรเจนโควาเลนต์พันธบัตร" โดย Jacek FH - งานของตัวเอง (CC BY-SA 3. 0) ผ่านทาง Commons "IonicBondingRH11" โดย Rhannosh - งานของตัวเอง (CC BY-SA 3. 0) ผ่านวิกิมีเดียคอมมอนส์


