ความแตกต่างระหว่าง Monatomic และ Diatomic | Monatomic vs Diatomic
ความแตกต่างระหว่าง monatomic และ diatomic เป็นเรื่องเกี่ยวกับอะตอมที่มีอยู่ในสายพันธุ์ ตามคำแนะนำทั้งสองคำเหล่านี้ยืนสำหรับรัฐที่แตกต่างกันของสมาคมอะตอมที่ 'โมโน' หมายถึง 'หนึ่ง' และ 'di' หมายถึง 'สอง 'โมโนกาติกหมายถึงหนึ่ง'
อะตอมหนึ่ง 'และ' diatomic means ' สองอะตอม ' อย่างไรก็ตามอาจมีรูปแบบที่แตกต่างกันมากมายในคำนิยามพื้นฐานนี้
Monatomic คืออะไร?เมื่อ
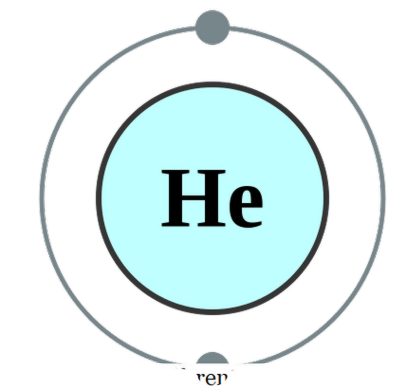
อะตอมเดี่ยวมีอยู่ในตัวเอง (ซึ่งแทบจะไม่เป็นเช่นนั้น) เราเรียกว่าเป็นโมโนโทนิค ซึ่งหมายความว่าองค์ประกอบต่างๆอยู่ในรูปเอกพจน์อันบริสุทธิ์ ตัวอย่างการปฏิบัติที่อาจอยู่ภายใต้หมวดนี้จะเป็นก๊าซที่มีตระกูลที่มีอยู่เป็นอะตอมด้วยตัวเองเนื่องจากมีเปลือกนอกที่เต็มด้วย octet ของอิเล็กตรอน ดังนั้นพวกเขาจึงไม่ต้องการรับหรือบริจาคอิเล็กตรอนเพิ่มเติมเพื่อให้มีเสถียรภาพมากขึ้น ดังนั้นก๊าซโนเบิลจึงมีเสถียรภาพในรูปแบบโมโนโทนิค ตัวอย่างคือ; He - ฮีเลียม Ne - Neon, Ar - Argon, Xe - ซีนอน, Kr - Krypton, Rn - Radon
ไดอะตอมคืออะไร?
เมื่อ
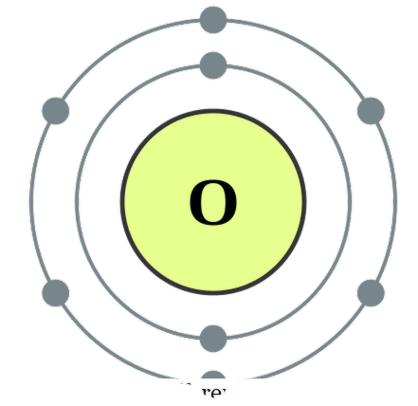
อะตอมสองอะตอมมีความเกี่ยวพันกัน เราเรียกว่า diatomic อะตอมเหล่านี้อาจมาจากชนิดเดียวกันหรือต่างกัน เมื่อมีอะตอมคล้ายกันสองอะตอมที่เรียกว่า ' อนุภาคมูลฝอย ' และถ้าเกิดขึ้นในรูปแบบต่างๆเราเรียกว่า ~ ไดอะตอม heteronuclear ' ตัวอย่างสำหรับไดอะตอมที่เป็นนิวเคลียสบางตัวจะเป็น O2, N2, H2, ฯลฯ ในขณะที่ CO, NO, HCl ฯลฯ เป็นตัวอย่างสำหรับไดอะตอมไฮโดรเจนนิวเคลียร์ ออกซิเจน ไดอะตอมสามารถถือเป็นสารประกอบเมื่อสร้างความสัมพันธ์เหล่านี้เพื่อให้เกิดความมั่นคงมากขึ้นโดยการแบ่งปันอิเล็กตรอนร่วมกันเพื่อให้ทั้งสองอะตอมสามารถบรรลุการกำหนดค่าทางอิเล็กทรอนิกส์ของก๊าซมีตระกูล พวกเขาสามารถพันธบัตรผ่านพันธะโควาเลนต์โดยการทับซ้อนของ orbitals อะตอมหรืออื่น ๆ ที่พวกเขาสามารถสร้างพันธบัตรไอออนิกในหมู่พวกเขาซึ่งเป็นแรงดึงดูดระหว่างสายพันธุ์บวกกับสายพันธุ์ค่าใช้จ่ายในทางลบ ตัวอย่างของพันธะโควาเลนต์ในหมู่ไดอะตอม ได้แก่ CO, NO, ฯลฯ และ HCl ถือได้ว่าเป็นสายพันธุ์ที่มีตัวดึงดูดไอออนิก อย่างไรก็ตามแรงจูงใจระหว่าง H + และ Cl- ไม่แข็งแรงมากไม่ใช่ตัวอย่างที่ดีมากสำหรับพันธบัตรไอออนิกที่เป็นหัวข้อที่กำหนดไว้อีก
อะไรคือความแตกต่างระหว่าง Monatomic และ Diatomic?
•ชนิดโมโนโครมมีอะตอมหนึ่งส่วนไดอะตอมมีอะตอม 2 อะตอม
• Monatomic species โดยทั่วไปไม่เสถียร แต่ diatomic species มักมีเสถียรภาพ
•ก๊าซโนเบิลเป็นเพียงโมโนโครมและไม่พบในรูปแบบไดอะทโมมา
•มีพันธะทางเคมีอยู่ระหว่างชนิดไดอะตอมในขณะที่ไม่มีพันธะในรูปแบบโมโนโครม
ภาพอนุญาติ:
การกำหนดค่าฮีเลียมอิเล็กตรอนโดย Pumbaa (CC BY-SA 2. 0 uk)
การกำหนดค่าอิเล็กตรอนออกซิเจนโดย DePiep (CC BY-SA 3. 0)