ความแตกต่างระหว่าง Octet และ Duplet | Octet vs Duplet
ความแตกต่างที่สำคัญ - Octet vs Duplet
มีอะตอมที่ใช้งานหรือไม่ใช้งานหรือสารประกอบที่มีอยู่ในธรรมชาติ ลักษณะนี้ส่วนใหญ่จะขึ้นอยู่กับจำนวนอิเล็กตรอนที่อยู่ในเปลือกนอกสุดของอะตอม อะตอมที่มีเปลือกหอยไม่สมบูรณ์อาจทำงานได้เพื่อให้การกำหนดค่าของอิเล็กตรอนสมบูรณ์ขึ้นเพื่อให้เสถียร อะตอมที่ไม่ได้ใช้งานมีการกำหนดค่าอิเล็กตรอนสมบูรณ์ ดังนั้นอะตอมเหล่านี้ไม่ทำปฏิกิริยากับอะตอมอื่นใดนอกจากในสภาวะพิเศษ ก๊าซโนเบิลมักไม่มีการใช้งานในธรรมชาติ ดังนั้นพวกเขาจึงเรียกว่าก๊าซเฉื่อย ก๊าซเฉื่อยอยู่ในคอลัมน์ที่แปดในตารางธาตุ องค์ประกอบอื่น ๆ ในช่วงเวลาเดียวกัน (แถว) มักจะได้รับการกำหนดค่าอิเล็กตรอนของก๊าซเฉื่อยในตอนท้ายของระยะเวลานั้นซึ่งเป็นรูปแบบที่มีเสถียรภาพมากที่สุดในธรรมชาติ อะตอมที่ใช้งานมีแนวโน้มที่จะทำให้อิเล็กตรอนสมบูรณ์ตามกฎของ octet หรือกฎการซ้อนทับ ความแตกต่างที่สำคัญระหว่าง octet และ duplet คือ octet คืออะตอมหรือไอออนที่มีอิเล็กตรอนมากสุดแปดตัวในเปลือกนอกสุด ขณะที่ duplet คืออะตอมที่มีอิเล็กตรอนมากที่สุด 2 แห่งในเปลือกนอกสุด.
เนื้อหา
1 ภาพรวมและข้อแตกต่างที่สำคัญ
2. อะไรคือ Octet
3. Duplet คืออะไร
4. การเปรียบเทียบแบบเคียงข้างกัน - Octet vs Duplet
5. สรุป
Octet คืออะไร?
อะตอมเป็นอะตอมหรือไอออนที่มีอิเล็กตรอนแปดตัวอยู่ในเปลือกนอกสุดของอะตอมนั้น ก๊าซมีเทนทั้งหมดยกเว้นฮีเลียมมีอิเล็กตรอนแปดตัวและมีลักษณะเฉื่อยชา การกำหนดค่าอิเล็กตรอนของก๊าซโนเบิลจะสิ้นสุดลงดังนี้
ตัวอย่างเช่นการกำหนดค่าอิเล็กตรอนของนีออนคือ 1s2 2s 2 2p
6 นีออนเป็นก๊าซเฉื่อย องค์ประกอบอื่น ๆ ที่มีอิเล็กตรอน 7, 6 และอื่น ๆ ในวงโคจรนอกสุดมีแนวโน้มที่จะปฏิบัติตามกฎของ octet โดยการได้อิเล็กตรอนจากภายนอก องค์ประกอบอื่น ๆ ที่มีอิเล็กตรอนหนึ่ง, สอง, ฯลฯ มีแนวโน้มที่จะสูญเสียอิเล็กตรอนและได้รับการกำหนดค่าอิเล็กตรอนของก๊าซเฉื่อยที่ใกล้ที่สุด แต่องค์ประกอบอื่น ๆ ในตอนกลางของตารางธาตุจะสร้างพันธะใหม่กับองค์ประกอบที่มีอิเล็กตรอนส่วนเกินเพื่อแบ่งปันอิเล็กตรอนเหล่านั้นและกลายเป็น octet
2
2s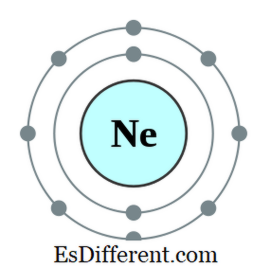
1
เมื่อถอดอิเล็กตรอน 2S
1 ออกจะกลายเป็น duplet ในกรณีนี้ He, H - และ Li + เป็น duplets ที่สามารถอยู่ได้เป็น duplets ที่เสถียร duplets ทั้งหมดมีการกำหนดค่าอิเล็กตรอนที่ลงท้ายด้วยดังนี้ ns 2 รูปที่ 02: Helium, duplet อะไรคือความแตกต่างระหว่าง Octet และ Duplet?
- diff บทความกลางก่อนตาราง -> Octet vs Duplet
Octet มีอิเล็กตรอนแปดตัวอยู่ในเปลือกนอกสุด Duplet มีอิเล็กตรอนสองตัวอยู่ในเปลือกนอกสุด

การกำหนดค่าอิเลคตรอนร่วม
Octet มี ns
2
np |
|
| 6 | การตั้งค่าอิเล็กตรอนชนิดที่ปลาย |
| Duplet มี ns | |
| 2 การกำหนดค่าประเภทที่สิ้นสุด จำนวน Orbitals Octet อาจมี orbitals อย่างน้อยสองตัว เลียนแบบมีวงโคจรเพียงดวงเดียว | ประเภท Orbitals Octet สามารถมี orbitals ได้ทุกประเภทเช่น s, p, d, f ฯลฯ Duplet มีวงโคจรเพียงดวงเดียว |
| ข้อมูลอย่างย่อ - Octet vs Duplet | |
| องค์ประกอบทั้งหมดมีแนวโน้มที่จะมีเสถียรภาพ แต่ด้วยการกำหนดค่าอิเล็กตรอนที่ไม่สมบูรณ์อะตอมจะไม่เสถียร ดังนั้นพวกเขากลายเป็นปฏิกิริยามากเพื่อที่จะเติมเปลือกหอยด้วยอิเล็กตรอนโดยการได้รับการสูญเสียหรือการแบ่งปันอิเล็กตรอน อะตอมหรือโมเลกุลที่เป็นไปตามกฎ octet หรือ duplet มีเสถียรภาพ ความแตกต่างที่สำคัญระหว่าง octet กับ duplet คือ octet มีอิเล็กตรอนแปดตัวอยู่ในวงโคจรด้านนอกสุดในขณะที่ duplet มีอิเล็กตรอนสองตัวอยู่ในวงโคจรของมัน | การอ้างอิง: |
| 1. Nema, P., 2011. Topperlearning [ออนไลน์] มีจำหน่ายที่: // www. topperlearning com / forums / home-work-help-19 / what-is-octet-duplet-valency-and-ion-chemistry-structure-of-the-atom-46317 / reply [เข้าใช้งาน 29 05 2017] | |
| 2 Chang, R., 2010. เคมี 10th ed. นิวยอร์ก: McGraw-Hill | 3 ไม่ช้า, ปี 2015 รถยกระดับ [ออนไลน์] มีจำหน่ายที่: // gradestack com / NTSE-Complete-Course / สารเคมีพันธะ / เคมีกิจกรรม -of-an / 19176-3853-37737-study-wtw [เข้าถึง 29 05 2017] |
รูปภาพมารยphép:
1. "Electron shell 002 Helium - ไม่มีป้ายชื่อ" โดย Pumbaa (งานต้นฉบับของ Greg Robson) - แผนภาพเปลือกอิเล็กตรอน (รุ่นที่ติดฉลากที่สอดคล้องกัน) (CC BY-SA 2. 0 uk) ผ่านทาง Commons Commons: Commons = 2. "Electron shell 010 Neon" โดย Pumbaa (ผลงานต้นฉบับของ Greg Robson) (CC BY-SA 2. 0 uk) via Commons Wikimedia



