ความแตกต่างระหว่าง Sigma และ Pi พันธบัตร ความแตกต่างระหว่าง
พันธบัตร Sigma คืออะไร?
พันธะ Sigma เป็นพันธะระหว่างอะตอมภายในโมเลกุลที่สร้างขึ้นตามแนวแกนที่เชื่อมต่อนิวเคลียสที่ถูกผูกไว้ของอะตอม
โมเลกุลของโมเลกุล
โมเลกุลจะเกิดขึ้นเมื่ออะตอมแลกเปลี่ยนหรือใช้อิเล็กตรอนร่วมกันผ่านพันธะเคมี มีสามประเภทของพันธบัตรเป็นหลัก พันธบัตรไอออนิกพันธบัตรโลหะและพันธบัตรโควาเลนต์ อะตอมจะแลกเปลี่ยนอิเล็กตรอนเพื่อให้อะตอมหนึ่งดวงกลายเป็นประจุบวกและมีประจุลบอื่น ๆ ทำให้พวกมันกลายเป็นแม่เหล็กดึงดูด ในพันธะโลหะอิเล็กตรอนจะกระจายตัวกันอย่างสม่ำเสมอผ่านโมเลกุลทั้งหมดทำให้เกิดอิเล็กตรอนอิสระที่ถูก delocalized ห่อหุ้มอิออนอิเล็กตรอนที่มีประจุบวกอยู่
ในพันธะโควาเลนต์จะมีการแบ่งอิเล็กตรอนร่วมกันและวิธีที่ใช้ร่วมกันคือความน่าจะเป็นของเมฆและอิเล็กตรอนที่อยู่ในตำแหน่งที่ซ้อนทับกันในลักษณะสมมาตรประมาณOrbitals และพันธบัตร sigma
Orbitals คือบริเวณรอบอะตอมที่เกี่ยวข้องกับระดับพลังงานบางอย่าง อิเล็กตรอนใน orbitals ไกลจากนิวเคลียสจะมีพลังงานมากกว่าอิเล็กตรอนใน orbitals ใกล้กับนิวเคลียส เมื่อ orbitals ของอะตอมหนึ่งซ้อนทับซ้อนกันกับ orbitals จากอะตอมอื่นที่พวกเขาสร้าง orbitals โมเลกุลที่อนุญาตให้มีพันธะโมเลกุลซึ่งแน่นอนสำหรับโมเลกุล
พันธบัตรซิกมาเป็นพันธะแบบแรกที่จะเกิดขึ้นระหว่างอะตอม ในพันธะ sigma, ความน่าจะเป็นของอิเล็กตรอนเมฆจะอยู่ตามแกนที่เชื่อมต่อนิวเคลียสของอะตอมที่ถูกยึด พันธบัตร Sigma มักจะเกิดขึ้นเมื่อ orbitals
sจากอะตอมที่แตกต่างกันทับซ้อนกันเพื่อสร้างพันธะ พวกเขาจะสร้างแกนตามแกนระหว่างนิวเคลียสทั้งสองเพราะวงโคจร จัดอยู่ในรูปคล้ายทรงกลมรอบนิวเคลียส อิเล็กตรอนที่ทำพันธะซิกมาจะอยู่ภายในวงโคจรของซิกมาและจะอยู่ที่ไหนสักแห่งตามแนวแกนที่เชื่อมต่อนิวเคลียสของอะตอมที่ถูกยึดไว้ อย่างไรก็ตามพันธะซิกมาจะมีเสถียรภาพหรือไม่เสถียรขึ้นอยู่กับว่าอิเล็กตรอนอยู่ในวงโคจรของพันธะซิกมาหรือวงโคจรของพันธะ พันธะโคจร sigma จะอยู่ในช่องว่างระหว่างนิวเคลียสขณะที่แอนตี้บอนด์จะอยู่ตามแกนที่เชื่อมต่อนิวเคลียส แต่อยู่ที่ด้านข้างของอะตอมตรงข้ามช่องว่างระหว่างกัน พันธบัตรซิกมาจะมีเสถียรภาพถ้าอิเล็กตรอนจำนวนมากอยู่ใน orbitals พันธะและไม่เสถียรถ้าอยู่ใน orbitals antibonding หรือถ้ามีจำนวนเท่ากันของอิเล็กตรอนในทั้งสอง พันธบัตร Pi คืออะไร?
พันธบัตร Pi เป็นพันธะระหว่างอะตอมภายในโมเลกุลที่อิเล็กตรอนอยู่ด้านบนและด้านล่างแกนที่เชื่อมต่อนิวเคลียสของอะตอมที่เข้าร่วม แต่ไม่อยู่ตามแกนพวกเขาเป็นประเภทที่สองของพันธบัตรซึ่งจะก่อตัวขึ้นภายในโมเลกุลหลังจากที่พันธบัตร sigmaพันธบัตร Pi และ
p
orbitals
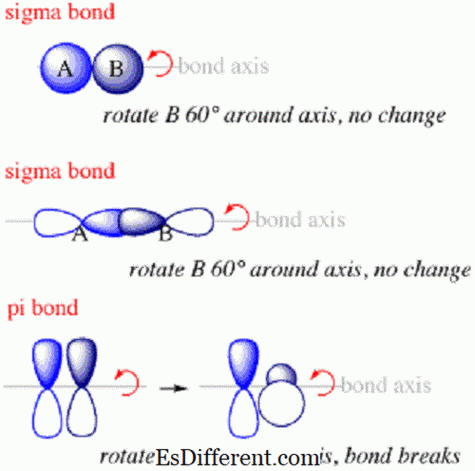
เหตุผลที่พันธบัตร pi อยู่ด้านบนและด้านล่างของแกนการยึดติด แต่ไม่อยู่ตามแนวนั้นเนื่องจากรูปแบบเหล่านี้มักเกิดจาก orbitals ซ้อนกันเช่น
p
orbitals บนอะตอมที่ถูกยึด orbitals เหล่านี้ไม่มีความหนาแน่นของอิเล็กตรอนที่นิวเคลียส เป็นผลให้อิเล็กตรอนที่สร้างพันธะ pi ที่เกิดจาก orbitals p ที่คาบเกี่ยวกันจะคลัสเตอร์ในพื้นที่ที่ไม่ได้อยู่ติดกับนิวเคลียสโดยตรง พันธบัตร Pi สามารถเกิดขึ้นระหว่าง orbitals อะตอมอื่น ๆ เช่น orbitals
d ซึ่งมีคุณสมบัติคล้ายกับ orbitals p พันธบัตร Pi และ orbitals pi เมื่อ orbitals p orbitals ของอะตอมที่แตกต่างกันทับซ้อนกันพวกเขาสร้าง orbitals ระดับโมเลกุลที่อนุญาตให้มีการสร้างพันธะ pi พันธบัตรอีกครั้งอาจมีเสถียรภาพหรือไม่เสถียรขึ้นอยู่กับวงโคจรที่อิเล็กตรอนตั้งอยู่ พันธะ pi จะคงที่ถ้าอิเล็กตรอนอยู่ในวงโคจรของพาย มันจะไม่เสถียรถ้ามีอยู่ใน orbitals ต่อต้านการยึดหรือถ้าจำนวนเท่ากันอยู่ในทั้งสอง ความคล้ายคลึงกันระหว่างพันธบัตร sigma กับ pi bond พันธบัตร Sigma และ pi bond จะขึ้นอยู่กับ orbitals โมเลกุลเฉพาะที่มาจากการทับซ้อนของ orbitals อะตอมโดยเฉพาะเช่น orbitals
s
ในกรณี ของพันธบัตร sigma และ orbitals p ในกรณีของพันธบัตร pi พวกเขายังสามารถมีเสถียรภาพหรือไม่เสถียรขึ้นอยู่กับว่าอิเล็กตรอนอยู่ใน orbitals โมเลกุลพันธะหรือต่อต้าน orbitals โมเลกุลของพันธะ
ความแตกต่างระหว่างพันธบัตร sigma กับพันธบัตร pi
แม้จะมีความเหมือนกัน แต่ก็มีความแตกต่างที่สำคัญ อิเล็กตรอนที่ทำพันธะ sigma จะกระจายตัวอยู่ในพื้นที่ตามแนวแกนที่เชื่อมต่อนิวเคลียสที่เชื่อมต่อกันในขณะที่อิเล็กตรอนภายในพันธบัตร pi จะกระจายตัวอยู่เหนือและใต้แกน แต่ไม่อยู่ในแนวเดียวกัน พันธบัตร Sigma เป็นพันธะแรกที่สร้างขึ้นระหว่างอะตอมภายในโมเลกุลในขณะที่พันธบัตร pi เป็นอันดับที่สอง พันธบัตร Sigma มักเกิดขึ้นโดยการรวมกันของ orbitals s
ในอะตอมที่แตกต่างกันส่วน pi bond จะเกิดขึ้นจากการรวมกันของ
p
- และ orbitals ที่คล้ายกันในอะตอมต่างๆ
- นอกจากนี้การวางแนวของ orbitals ซ้อนทับที่เป็นรูปวงรี pi จะตั้งฉากกับที่ของ orbitals ซ้อนทับกันซึ่งสร้างพันธะ sigma
- พันธบัตร Sigma กับพันธบัตร pi พันธบัตร Sigma พันธบัตร Pi อะตอม orbitals ซ้อนทับซ้อนกันตามแกนพันธะ อะตอม orbitals ทับซ้อนกันด้านบนและด้านล่างแกนพันธะ
- พันธะแรกที่สร้างขึ้นระหว่างอะตอมภายในโมเลกุล


