ความแตกต่างระหว่าง Valency และ Valence Electrons | ความถูกต้องและความถนัด Electrons
ความแตกต่างที่สำคัญ - ความถูกต้องและความถนัดอิเล็กตรอน
อิเล็กตรอนและอิเล็กตรอนความคลาดเคลื่อนเป็นข้อกำหนดระหว่างกันและ ความแตกต่างสำคัญ ระหว่าง valency และ valence electrons จะอธิบายได้ดีที่สุดในคำนิยาม อิเล็กตรอน อิเล็กตรอนความจุ เป็นอิเล็กตรอนในเปลือกนอกสุดของธาตุ ขณะที่ อิเล็กตรอนที่มีค่าเป็น คือจำนวนอิเล็กตรอนที่ควรได้รับการยอมรับหรือถูกลบออกเพื่อให้ได้ค่าก๊าซโนเลตที่ใกล้ที่สุด เป็นอิเล็กตรอนในเปลือกนอกสุดที่มักจะก่อให้เกิดพันธะเคมี ในอะตอมบางจำนวนอิเล็กตรอนความจุจะเท่ากับจำนวนอิเล็กตรอนความคลาดเคลื่อน
อิเลคตรอน V คืออะไร? จำนวนอิเล็กตรอนในเปลือกนอกสุดของอะตอมเรียกว่า "อิเล็กตรอนความว่องไว" ด้วยเหตุนี้เปลือกนอกสุดของอะตอมเรียกว่า "valence shell" ส่วนใหญ่เป็นอิเล็กตรอนซึ่งมีส่วนร่วมในพันธะเคมี เมื่อธาตุฟอร์ม cations พวกเขาเอาอิเล็กตรอนออกจากเปลือกความจุ จำนวนอิเล็กตรอนความจุในธาตุกำหนดกลุ่มในตารางธาตุ
อิเล็กตรอนความถนัดคืออะไร?

ความแตกต่างของธาตุกลุ่มหลัก
สำหรับธาตุโลหะ จำนวนอิเลคตรอนที่มีค่า = จำนวนอิเล็กตรอนความจุ
|
อิเล็กตรอนความนวน:
อิเล็กตรอนความคลาดเคลื่อน:
จำนวนอิเล็กตรอนที่ควรได้รับการยอมรับหรือลบเพื่อให้เกิดการกำหนดค่าอิเล็กตรอนของก๊าซมีเทนที่อยู่ใกล้ที่สุดเรียกว่า "valency electrons" หรือ "valence" ของอะตอม โดยทั่วไปสำหรับธาตุโลหะ (ธาตุในกลุ่ม I, II และ III) จำนวนอิเล็กตรอนความจุจะเท่ากับจำนวนอิเล็กตรอนความคลาดเคลื่อน พวกเขาเอาอิเล็กตรอนในเปลือกหอยเพื่อบรรลุโครงสร้าง octet
แต่ธาตุที่ไม่ใช่โลหะจะรับอิเล็กตรอนเพื่อให้เกิดการกำหนดรูปอิเล็กตรอนของก๊าซโนเลตที่ใกล้ที่สุด ดังนั้นความถูกต้องของธาตุที่ไม่ใช่โลหะคำนวณโดยการลบอิเล็กตรอนความจุโดยรวมจาก 8.
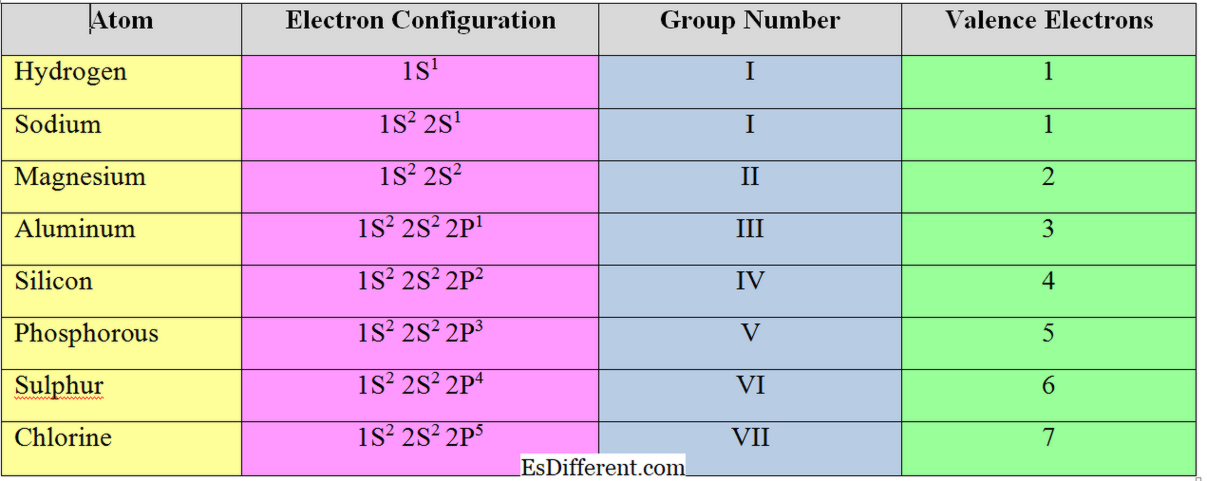
สำหรับคลอรีน, จำนวนอิเล็กตรอนที่มีความคลาดเคลื่อน = 8-7 = 1 ลักษณะของความเที่ยงตรงและความอิ่มตัวของอิเล็กตรอน
ความถูกต้องและ อิเล็กตรอนความจุของธาตุกลุ่ม VIII
อิเล็กตรอนความจุ:
ธาตุกลุ่ม VIII เป็นก๊าซที่มีตระกูลสูงและมีความเสถียรทางเคมี เปลือกนอกของมันสมบูรณ์และประกอบด้วยแปดอิเล็กตรอนในเปลือกนอกสุด (ยกเว้นฮีเลียม - เฮ) เพื่อให้อิเล็กตรอนกลุ่ม VIII มีอิเล็กตรอนความจุแปด

อิเล็กตรอนความถนัด:
ความเที่ยงตรงเป็นตัวชี้วัดความสามารถในการสร้างพันธะกับองค์ประกอบหรือโมเลกุลอื่น ๆ ก๊าซโนเบิลไม่ยอมรับหรือลบอิเล็กตรอนเพื่อให้ได้กฎตามกฎเนื่องจากพวกเขาได้ทำเปลือกหอยที่แล้วเสร็จเรียบร้อยแล้ว ดังนั้นค่าความถูกต้องของธาตุกลุ่ม VII เท่ากับศูนย์
รูปภาพมารยาท: "เปลือกอิเล็กตรอน 010 นีออน - ไม่มีป้ายกำกับ" โดยคอมมอน: ผู้ใช้: Pumbaa (งานต้นฉบับโดย commons: User: Greg Robson) - // commons. วิกิพีเดีย org / wiki / หมวดหมู่: Electron_shell_diagrams (เวอร์ชันที่มีข้อความตรงกัน) (CC BY-SA 2. 0 สหราชอาณาจักร) ผ่านทาง Commons




