ความแตกต่างระหว่าง 1S และ 2s Orbital | 1s vs 2s Orbital
ความแตกต่างที่สำคัญ - 1s vs 2s Orbital
Atom เป็นหน่วยที่เล็กที่สุดของสสาร กล่าวได้ว่าสารทั้งหมดถูกสร้างมาจากอะตอม อะตอมประกอบด้วยอนุภาคโมเลกุลส่วนใหญ่โปรตอนอิเล็กตรอนและนิวตรอน โปรตอนและอิเล็กตรอนทำนิวเคลียสซึ่งตั้งอยู่ตรงกลางของอะตอม แต่อิเล็กตรอนอยู่ในตำแหน่ง orbitals (หรือระดับพลังงาน) ซึ่งอยู่นอกนิวเคลียสของอะตอม นอกจากนี้ยังเป็นสิ่งสำคัญที่จะต้องทราบว่า orbitals เป็นแนวคิดสมมุติฐานที่ใช้ในการอธิบายตำแหน่งของอะตอม มี orbitals ต่างๆรอบนิวเคลียส นอกจากนี้ยังมี sub-orbitals เช่น s, p, d, f เป็นต้นวงโคจรย่อยมีรูปทรงกลมเมื่อพิจารณาว่าเป็นโครงสร้าง 3D วงโคจรของวงโคจรมีความเป็นไปได้สูงที่จะหาอิเล็กตรอนรอบนิวเคลียส วงโคจรย่อยจะถูกนับเป็น 1 วินาที, 2 วินาที, 3 วินาที ฯลฯ ตามระดับพลังงาน ความแตกต่างที่สำคัญระหว่างวงโคจรของ 1s และ 2s คือพลังงานของแต่ละวงโคจร วงโคจร 1 วินาทีมีพลังงานต่ำกว่าวงโคจรที่ 2
เนื้อหา
1 ภาพรวมและข้อแตกต่างที่สำคัญ
2. อะไรคือ 1s Orbital
3. อะไรคือวงโคจร 2 วินาที
4. การเปรียบเทียบแบบเคียงข้างกัน - 1s vs 2s Orbital
5. สรุป
1s Orbital คืออะไร?
วงโคจร 1 วินาทีเป็นวงโคจรใกล้กับนิวเคลียสมากที่สุด มีพลังงานน้อยที่สุดในหมู่ orbitals อื่น ๆ นอกจากนี้ยังเป็นทรงกลมเล็กที่สุด ดังนั้นรัศมีของวงโคจรของ s มีขนาดเล็ก สามารถมีได้เพียง 2 อิเล็กตรอนในวงโคจรของ s การกำหนดค่าอิเล็กตรอนสามารถเขียนเป็น 1s 1 ถ้ามีอิเล็กตรอนเพียงตัวเดียวในวงโคจรของ s แต่ถ้ามีคู่ของอิเล็กตรอนก็สามารถเขียนเป็น 1s 2 จากนั้นอิเล็กตรอนทั้งสองที่อยู่ในวงโคจรของวงโคจรจะเคลื่อนที่ไปในทิศทางตรงกันข้ามเพราะการขับไล่ที่เกิดขึ้นเนื่องจากมีประจุไฟฟ้าเดียวกันของอิเล็กตรอนสองตัว เมื่อมีอิเล็กตรอน unpaired เรียกว่า paramagnetic นั่นเป็นเพราะมันสามารถดึงดูดโดยแม่เหล็ก แต่ถ้าวงโคจรถูกเติมเต็มและมีอิเล็กตรอนอยู่คู่อิเล็กตรอนจะไม่ดึงดูดด้วยแม่เหล็ก นี้เรียกว่า diamagnetic
วงโคจร 2 วินาทีคืออะไร?
วงโคจรที่ 2 มีขนาดใหญ่กว่าวงโคจร 1 วินาที ดังนั้นรัศมีของมันมีขนาดใหญ่กว่าวงโคจร 1s เป็นวงโคจรของตู้ถัดไปที่นิวเคลียสหลังวงโคจร 1 วินาที พลังงานของมันสูงกว่าวงโคจร 1s แต่ต่ำกว่า orbitals อื่น ๆ ในอะตอม วงโคจร 2s สามารถเติมเต็มด้วยอิเล็กตรอนเพียงหนึ่งหรือสองเท่านั้น แต่วงโคจรของวงโคจร 2 วินาทีเต็มไปด้วยอิเล็กตรอนเฉพาะหลังจากที่วงโคจรของวงโคจรครบรอบ 1 วินาทีเท่านั้นนี้เรียกว่าหลักการ Aufbau ซึ่งระบุลำดับของอิเล็กตรอนที่กรอกข้อมูลลงในวงโคจรย่อย
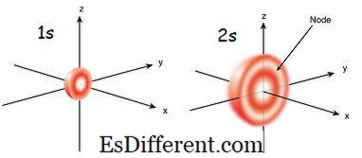
รูปที่ 01: 1s และ 2s Orbital
อะไรคือความแตกต่างระหว่าง Orbs 1s และ 2s?
- diff บทความ Middle ก่อน Table ->
1s vs 2s Orbital |
|
| วงโคจร 1 วินาทีเป็นวงโคจรที่ใกล้ที่สุดกับนิวเคลียส | วงโคจร 2 วินาทีเป็นวงโคจรที่ใกล้ที่สุดเป็นอันดับสองของนิวเคลียส |
| ระดับพลังงาน | |
| พลังงานของวงโคจร 1 วินาทีสูงกว่าวงโคจร 2 วินาที | 2 วินาทีมีพลังงานต่ำกว่า |
| รัศมีวงโคจร | |
| รัศมีของวงโคจร 1 วินาทีมีขนาดเล็กลง | รัศมีของวงโคจร 2s มีขนาดใหญ่มาก |
| ขนาดวงโคจรของวงโคจร | |
| วงโคจร 1 วินาทีมีรูปทรงกลมเล็กที่สุด | วงโคจร 2 วินาทีมีขนาดใหญ่กว่าวงโคจร 1 วินาที |
| การเติมอิเลคตรอน | |
| อิเลคตรอนจะถูกบรรจุเป็นครั้งแรกในวงโคจร 1 วินาที | วงโคจรของวงโคจร 2 วินาทีจะเต็มหลังจากที่อิเล็กตรอนเสร็จสิ้นในวงโคจรที่ 1 |
ข้อมูลอย่างย่อ - 1s vs 2s Orbital
อะตอมเป็นโครงสร้าง 3 มิติที่มีนิวเคลียสอยู่ตรงกลางล้อมรอบด้วย orbitals ที่มีรูปร่างต่างกันในระดับพลังงานที่แตกต่างกัน orbitals เหล่านี้จะถูกแบ่งออกเป็น sub-orbitals อีกครั้งตามความแตกต่างเล็กน้อยของพลังงาน อิเล็กตรอนซึ่งเป็นอนุภาคย่อยที่สำคัญของอะตอมจะอยู่ในระดับพลังงานเหล่านี้ 1s และ 2s sub-orbitals ใกล้ที่สุดกับนิวเคลียส ความแตกต่างหลักระหว่าง orbitals 1s และ 2s คือความแตกต่างของระดับพลังงานของพวกเขาซึ่งก็คือวงโคจร 2s เป็นระดับพลังงานที่สูงกว่าวงโคจร 1 วินาที
การอ้างอิง:
1. Libretexts "อะตอม Orbitals "LibreTexts เคมี Libretexts, 03 Nov. 2015 เว็บ 26 พฤษภาคม 2017
2 อะตอมอิเล็กตรอนและ Orbitals N. p., n d เว็บ. 26 พฤษภาคม 2017
รูปภาพมารยphép:
1. "S orbitals" (ครอบตัด) โดย CK-12 Foundation - ไฟล์: เคมีโรงเรียนมัธยม pdf, หน้า 265 (CC BY-SA 3. 0) ผ่านวิกิมีเดีย



