ความแตกต่างระหว่างการไตเตรท Acid-Base และการไตเตรท Redox การไตเตรท Acid-Base เทียบกับการไตเตรท Redox
ความแตกต่างหลัก - การวัดค่าของกรด - เบสเทียบกับการไตเตรท redox
การไตเตรทจะใช้เพื่อหาค่าความเข้มข้นของสารละลายที่ไม่รู้จัก (analyte) วิธีที่นิยมใช้มากที่สุดคือวิธีการไตเตรทแบบกรด - เบสและการทำไทเทเนียมรีดอกซ์ ความแตกต่างสำคัญ ระหว่างการไตเตรทกรด - เบสและการไทเทรัตของสารรีดอกซ์ คือลักษณะของปฏิกิริยาที่เกิดขึ้นระหว่างซีรั่มและ analyte ในการไตเตรท ในการไตเตรทกรดเบสจะเกิดปฏิกิริยาการวางตัวเป็นกลางและในการทำปฏิกิริยาไทเทเนียมรีดอกซ์ปฏิกิริยารีดอกซ์จะเกิดขึ้น (ปฏิกิริยาออกซิไดส์และปฏิกิริยาลด) การใช้ตัวบ่งชี้เป็นวิธีที่ใช้บ่อยที่สุดในการกำหนดจุดสิ้นสุดของปฏิกิริยา
การไตเตรทกรด - เบสคืออะไร?ในการไตเตรทกรด - เบสจะใช้กรด (การไตเตรทเป็นกรด) หรือฐาน (การไทเทรนขั้นพื้นฐาน) เป็นตัวยึดสี ตัวอย่างของกรดที่ใช้ในการไตเตรทเป็นกรดคือ H
2 SO 4 , HCl หรือ HNO 3 ส่วนใหญ่ใช้ค่าไทม์พื้นฐานคือ NaOH, K 2 CO 3 หรือ Na 2 CO 3 การไตเตรทกรดเป็นไปตามความเข้มข้นของกรดและเบส
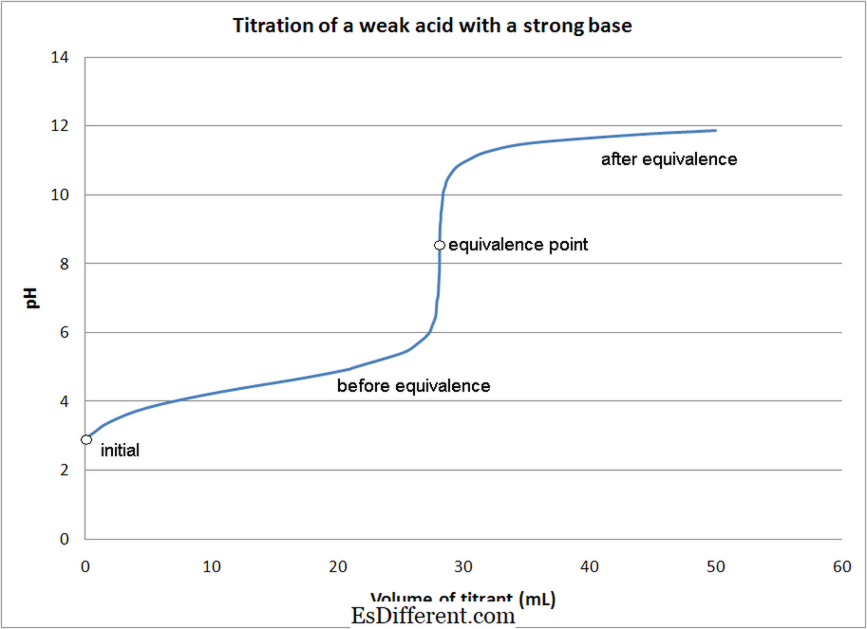
กรดอ่อน - เบสที่อ่อนแอไททาเนียม- กรดอ่อน - การยึดเกาะที่แรงเบส
- กรดอ่อน - การไตเตรทพื้นฐานที่อ่อนแอ
- ในกรดส่วนใหญ่ ตัวบ่งชี้ที่ใช้ในการกำหนดจุดสิ้นสุดของปฏิกิริยา ใช้ตัวชี้วัดที่แตกต่างกันขึ้นอยู่กับชนิดของการไตเตรทตามที่กล่าวมา
การทำ Titress Redox คืออะไร?
อะไรคือความแตกต่างระหว่างการไตเตรท Acid-Base และ Redox Titration?
ลักษณะของปฏิกิริยา:

การไตเตรทกรด - เบส:
การไตเตรทกรด - เบสเกี่ยวข้องกับปฏิกิริยาการวางตัวเป็นกลางระหว่างตัววิเคราะห์ (สารละลายที่มีความเข้มข้นไม่ทราบ) กับตัวทำละลายที่เป็นกรดหรือเบส
Reduction Titration: ปฏิกิริยา redox เกี่ยวข้องกับปฏิกิริยาการเกิดออกซิเดชันและการลดระหว่าง analyte และตัวยึด ไม่มีกฎดังกล่าวที่ส่วนประกอบ oxidizes และที่หนึ่งลดลง ตัววิเคราะห์หรือตัวทำละลายจะออกซิไดซ์และส่วนประกอบที่เหลือจะลดลงตามลำดับ
การวัดค่าของกรด - เบส: โดยทั่วไปเครื่องวัดค่า pH เครื่องวัดค่า pH หรือเครื่องวัดค่าการนำไฟฟ้าใช้เพื่อกำหนดจุดสิ้นสุดของการไตเตรทกรด - เบส
Reduction Titration:
วิธีการที่ใช้บ่อยที่สุดในการกำหนดจุดสิ้นสุดของปฏิกิริยา redox ใช้โพเทนชิออมิเตอร์หรือตัวบ่งชี้ redox แต่บ่อยที่สุดทั้ง analyte หรือ titrant สร้างสีที่จุดสิ้นสุด เพื่อให้ตัวชี้วัดเพิ่มเติมไม่จำเป็นต้องใช้ในกรณีดังกล่าว ตัวอย่าง:
การไตเตรทกรด - เบส: -
ประเภท
ปฏิกิริยา (ตัวบ่งชี้)
กรดที่แข็งแกร่ง - การไตเตรทพื้นฐานที่แข็งแรง| HCl + NaOH แนสซี + H | 2 |
| O (Phenolphthalein / Methyl ส้ม) | กรดแก่ - การไตเตรทฐานอ่อนแอ HCl + NH 3 |
| NH | 3 Cl (เมธิลส้ม) กรดอ่อน - การไตเตรทที่แข็งแกร่ง CH 3 |
| COOH + NaOHα CH | 3 COONa + H 2 O (Phenolphthalein) การละลายในน้ำนมที่อ่อนแอ CH 3 |
| COOH + NH | 3 à> 3 COO - + NH 4 + (ไม่มีตัวบ่งชี้ที่เหมาะสม) Redox Titration: 2 KMnO 4 |
+ 5 H
2 C 2 O 4 + 6 HCl → 2 MnCl 2 + 2 KCl + 10 CO 2 + 8 H 2 O (+ 7) (+3) (+2) (+ 4) ในปฏิกิริยาข้างต้นเปอร์ออกไซด์จะลดลงในขณะที่กรดออกซาลออกซิไดซ์ เมื่อปฏิกิริยาเสร็จสิ้นลงสีม่วงแทนด่างจะเปลี่ยนเป็นสี KMnO 4
+ 5FeCl>
2
O (+ 7) (+2) (+3) (+2) รูปภาพมารยphép: 1. การไตเตรทของกรดอ่อนและมีเบสที่แข็งแกร่งโดย Quantumkinetics (Own work) [CC BY 3. 0], Wikisource Commons 2. "Winkler Titration Prior Titration" โดย Willwood [CC BY-SA 3. 0] ผ่านทาง Commons


