ความแตกต่างระหว่าง S และ P Block Elements | S vs P Block Elements
ความแตกต่างที่สำคัญ - S เทียบกับ P Block Elements
ความแตกต่างหลัก ระหว่างส่วนประกอบ s และ p block สามารถอธิบายได้ดีที่สุดโดยใช้การกำหนดค่าแบบอิเล็กทรอนิกส์ ในองค์ประกอบบล็อก s, อิเล็กตรอนสุดท้ายเติมให้กับ subshell s และใน p block elements อิเล็กตรอนตัวสุดท้ายจะเติมลงใน subshell p เมื่อพวกเขาฟอร์มไอออน; s องค์ประกอบบล็อกลบอิเล็กตรอนของพวกเขาจาก subshell นอกสุดได้อย่างง่ายดายในขณะที่องค์ประกอบ p บล็อกรับอิเล็กตรอนไป subshell p หรือลบอิเล็กตรอนจาก subshell p - องค์ประกอบบางอย่างในกลุ่ม p สร้างประจุบวกเอาอิเล็กตรอนออกจากชั้นนอกสุด p-subshell และองค์ประกอบบางอย่าง (ธาตุที่มีประจุไฟฟ้ามากที่สุด) จะสร้างประจุลบที่รับอิเล็กตรอนจากตัวอื่น ๆ เมื่อพิจารณาสมบัติทางเคมีแล้วจะมีความแตกต่างระหว่างองค์ประกอบของธาตุ s และ p นี้เป็นพื้นเนื่องจากการกำหนดค่าอิเล็กตรอน
S-block Elements คืออะไร?
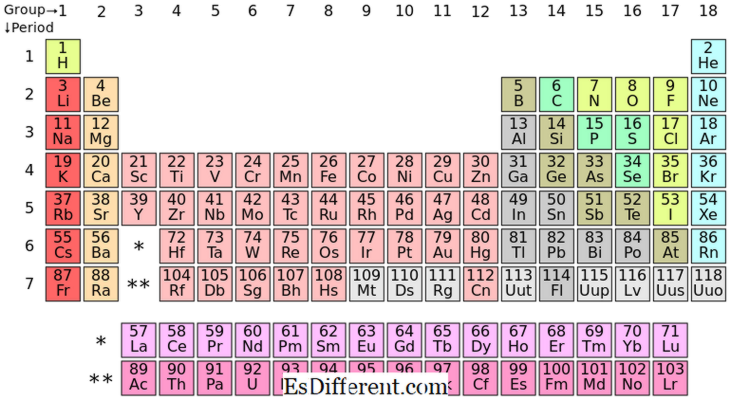
องค์ประกอบของ S-block เป็นองค์ประกอบทางเคมีในกลุ่ม I และกลุ่ม II ในตารางธาตุ เนื่องจาก subshell สามารถรองรับอิเล็กตรอนเพียงสองอิเล็กตรอนองค์ประกอบเหล่านี้มักมีอิเล็กตรอน (กลุ่ม I) หรือสอง (กลุ่ม II) ในเปลือกนอกสุด องค์ประกอบในกลุ่ม I และ II แสดงไว้ในตารางด้านบน
- บทความต่าง ๆ ก่อนกลางตาราง -> IA| II A | 2 | |
| Li | ต้อง | 3 |
| Na | Mg | 4 |
| K | Ca | 5 |
| Rb | Sr | 6 |
| Cs | Ba | 7 |
| Fr | Ra | |
| โลหะอัลคาไล | II A |
| โลหะอัลคาไลน์เอิร์ ธ | องค์ประกอบทั้งหมดใน s-block เป็นไอออนบวกและมีปฏิกิริยามาก |
ตำแหน่งของ S-block Elements ในตารางธาตุ
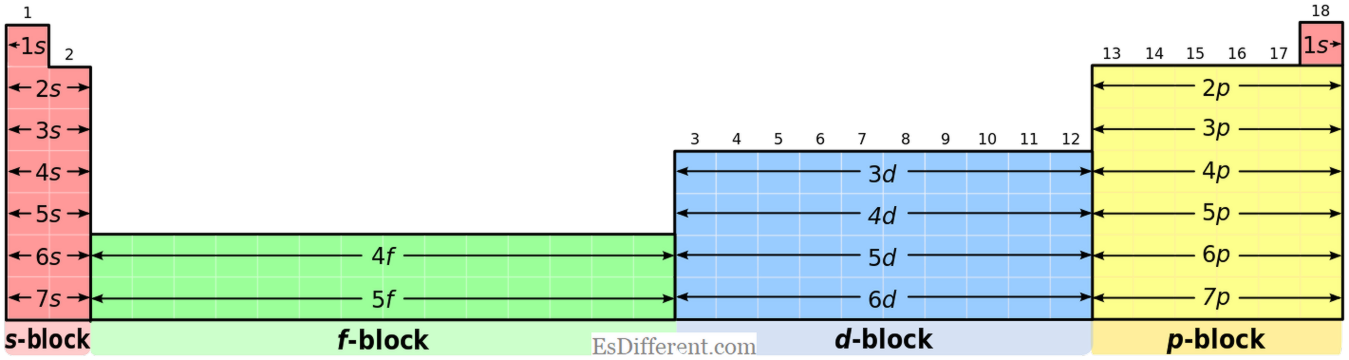
องค์ประกอบของ P-block เป็นองค์ประกอบที่อิเล็กตรอนตัวสุดท้ายเติมลงใน subshell p มีสาม p-orbitals; วงโคจรแต่ละดวงสามารถรองรับอิเล็กตรอนได้สองอิเล็กตรอนทำให้อิเล็กตรอนทั้งหมดหกตัว ดังนั้นองค์ประกอบ p-block มีอิเล็กตรอน p-1-6 ในเปลือกนอกสุด P-block มีทั้งโลหะและอโลหะ นอกจากนี้ยังมี metalloids บางเกินไป
13
| 14 | 15 | 16 | 17 | 18 | 2 | |
| B | C | N | O | F Ne | 3 | อัล |
| ศรี | P | S | Cl | Ar | 4 | Ga |
| Ge | ในฐานะที่เป็น | Se | Br | Kr | 5 | ใน |
| Sn | Sb | Te | ฉัน | Xe | 6 | Tl |
| Pb Bi | Po | ที่ | Rn | ความแตกต่างระหว่างองค์ประกอบของ S และ P คืออะไร? | การกำหนดค่าอิเลคตรอนร่วม: | องค์ประกอบของ S-block: |
องค์ประกอบ S-block มีการกำหนดค่าอิเล็กตรอนร่วมกันของ [noble gas] ns
1
(สำหรับกลุ่ม I elements) และ [noble gas] ns 2 (สำหรับองค์ประกอบกลุ่ม II) องค์ประกอบ P-block: องค์ประกอบ P-block มีการกำหนดค่าอิเล็กตรอนร่วมกันของ [noble gas] ns 2
np 1-6 แต่ฮีเลียมมีการกำหนดค่า 1 วินาที 2 มันเป็นสถานการณ์พิเศษ รัฐออกซิเดชั่น: องค์ประกอบของ S-block: องค์ประกอบของ S-block ไม่แสดงสถานะออกซิเดชั่นหลายอย่างเช่นองค์ประกอบ p-block ตัวอย่างเช่นองค์ประกอบของกลุ่ม I แสดงสถานะออกซิเดชั่น +1 และองค์ประกอบของกลุ่ม II แสดงสถานะออกซิเดชัน +2
องค์ประกอบของ P-block:
ไม่เหมือนองค์ประกอบของ s-block องค์ประกอบของ p-block มีสถานะการเกิดออกซิเดชันร่วมกันสำหรับกลุ่มของพวกเขาในตารางธาตุและสถานะออกซิเดชันอื่น ๆ บางส่วนขึ้นอยู่กับความเสถียรของไอออน กลุ่ม
13 14
| 15 | 16 | 17 | 18 | การกำหนดค่าอิเล็กตรอนทั่วไป | ns | 2 |
| np | 1 NS 2 NP | 2 NS 2 NP | 3 NS 2 NP | 4 ns 2 np 5 | ns 2 np 6 | 1 st สมาชิกของกลุ่ม เป็น < 9 |
| F เขา | เลขออกซิเดชั่นทั่วไป | +3 | +4 | +5 | -2 | -1 |
| 0 | สถานะออกซิเดชั่นอื่น ๆ | +1 | +2, -4 | +3, -3 | +4, +2, | +3, +5, + 1, +7 |
| - | คุณสมบัติ: | องค์ประกอบของ S-block: | โดยทั่วไปองค์ประกอบของ S-block ทั้งหมดเป็นโลหะ พวกเขาเป็นเงา, ตัวนำไฟฟ้าและความร้อนที่ดีและง่ายต่อการลบอิเล็กตรอนออกจากเปลือกแข็ง พวกเขาเป็นองค์ประกอบปฏิกิริยามากที่สุดในตารางธาตุ | องค์ประกอบของ P-block: | ส่วนประกอบ p-block ส่วนใหญ่เป็นโลหะที่ไม่ใช่ พวกเขามีจุดเดือดต่ำตัวนำที่ไม่ดีและยากที่จะเอาอิเล็กตรอนออกจากเปลือกนอกสุด แต่พวกเขาได้รับอิเล็กตรอน บางส่วนของโลหะที่ไม่ใช่เป็นของแข็ง (C, P, S, Se) ที่อุณหภูมิห้องขณะที่บางส่วนเป็นก๊าซ (ออกซิเจนไนโตรเจน) โบรมีนเป็นโลหะที่ไม่ใช่โลหะและเป็นของเหลวที่อุณหภูมิห้อง | นอกจากนี้ p-block ยังมีธาตุโลหะบางชนิด อลูมิเนียม (Al) แกลเลียม (Ga) อินเดียม (In) ดีบุก (Sn) แทลเลียม (Tl) ตะกั่ว (Pb) และบิสมัท (Bi) |
รูปภาพมารยphép:
1. "ตารางธาตุ (polyatomic)" โดย DePiep [CC BY-SA 3 0] ผ่านทาง Commons 2. "การบล็อกตารางธาตุ spdf (32 คอลัมน์)" โดยผู้ใช้: DePiep [CC BY-SA 3 0] via Commons




